盈科|解读 《药品专利纠纷早期解决机制实施办法》图示化分析
已被浏览554次
更新日期:2022-11-25
来源:盈科律师事务所
2020年《专利法》第四次修正案第七十六条正式确定了药品专利链接制度。随后,2021年7月国家药监局和国家知识产权局发布并实施《药品专利纠纷早期解决机制实施办法(试行)》。国家知识产权局制定并发布《药品专利纠纷早期解决机制行政裁决办法》,以对行政裁决进行规范。最高人民法院发布《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》,确定药品专利链接制度涉及专利权纠纷由北京知识产权法院管辖。至此,药品专利链接制度立法及司法框架已经形成。
现将《药品专利纠纷早期解决机制实施办法》的内容及逻辑结构进行了梳理,分享给大家,以对了解、熟悉和运用该规则提供一些帮助。
《药品专利纠纷早期解决机制实施办法(试行)》逻辑图如下:
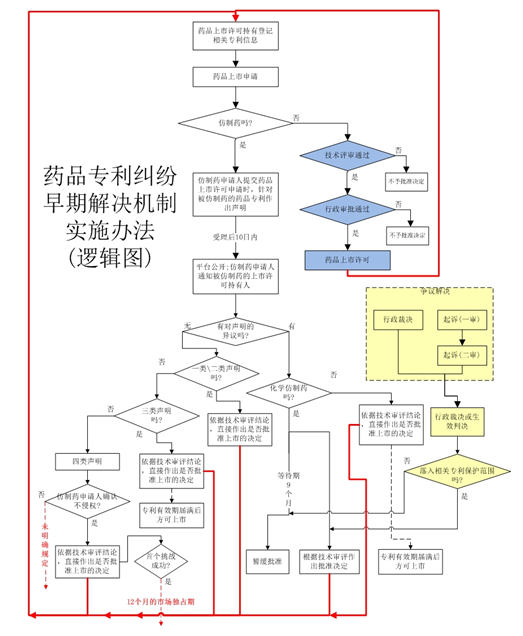
《药品专利纠纷早期解决机制实施办法(试行)》内容梳理如下:
一、目的:
保护药品专利权人合法权益【1】;
鼓励新药研究【1】;
促进高水平仿制药发展【1】。
二、组织机构及职能或职责:
1.国务院国家药品监督管理局负责建立中国上市药品专利信息登记平台【2】;
2.国家药品监督管理局药品审评中心负责:a.建立并维护中国上市药品专利信息登记平台;b.对已获批上市药品的相关专利信息予以公开【3】;
3.国家知识产权局药品专利纠纷早期解决机制行政裁决委员会负责组织和开展药品专利纠纷早期解决机制行政裁决相关工作;
4.北京知识产权法院管辖涉及该争议的一审诉讼案件,当然,还管辖基于国家知识产权局药品专利纠纷早期解决机制行政裁决委员会作出行政裁决的一审行政诉讼。
三、适用范围:
1、在中国上市药品专利信息登记平台登记的专利【2】;
2、药品专利包括:化学药品(不含原料药)的药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;中药的中药组合物专利、中药提取物专利、医药用途专利;生物制品的活性成分的序列结构专利、医药用途专利。不包括中间体、代谢产物、晶形、制备方法、检测方法等的专利;
3、未在中国上市药品专利信息登记平台登记相关专利信息的,不适用本办法【2】。
四、药品上市许可持有人登记:
1、主体:药品上市许可持有人【4】;
2、时限:在药品注册证书后30日内登记相关专利信息【4】 ;
3、登记内容:相关专利信息【4】;
4、变更登记:相关信息变化的,应当在信息变更生效30日内完成更新【4】;
5、异议登记:收到相关异议的,应当及时核实处理【4】;
6、对应性登记:保证专利信息与药品注册信息一致及相对应(注明相关专利保护范围覆盖获批上市药品的相应技术方案)【4】;
7、药品上市许可持有人对其登记的相关信息的真实性、准确性和完整性负责【4】。
五、仿制药申请人声明:
1、仿制药包括:化学仿制药、同名同方中成药、生物类似药【12】;
2、仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明【6/12】。
3、声明的具体要求【6】:
(1)上传平台,仿制药申请被受理后10个工作日内,平台公开;
(2)仿制药申请被受理后10个工作日内,仿制药申请人应当将相应声明及声明依据通知被仿制药的上市许可持有人;
(3)声明未落入相关专利权保护范围的,声明依据应当包括仿制药技术方案与相关专利的相关权利要求对比表及相关技术资料;
(4)除纸质资料外,仿制药申请人还应当向上市许可持有人在中国上市药品专利信息登记平台登记的电子邮箱发送声明及声明依据,并留存相关记录;
(5)仿制药申请人对相关声明的真实性、准确性负责。
4、声明分为四类【6】:
(1)中国上市药品专利信息登记平台中没有被仿制药的相关专利信息;
(2)中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可;
(3)中国上市药品专利信息登记平台收录有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;
(4)中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
六、对声明的异议:
1、异议主体:专利权人或利害关系人(利害关系人指相关专利的被许可人或者登记的药品上市许可持有人)【7】;
2、异议对象:四类声明【7】;
3、异议时限:国家药品审评机构公开药品上市许可申请之日起45日内【7】;
4、异议方式【7】:
(1)起诉或请求行政裁决(对行政裁决不服的,向法院起诉);
(2)受理之日起15个工作日内将立案或受理通知书副本提交国家药品审评机构,并通知仿制药申请人;
(3)异议程序当事人:(专利权人or被许可人or相关药品上市许可持有人)PK药品上市许可申请人;药品上市许可申请人PK专利权人。
七、异议等待期 :
1、针对的对象:化学仿制药注册申请的异议【8】;
2、等待期:9个月(自人民法院立案或者国务院专利行政部门受理之日起,只设置一次)【8】;
3、等待期内国家药品审评机构不停止技术审评【8】。
八、引发等待期的处理 :
1、收到判决或决定后,各方应当在10个工作日内报国家药品审评机构【9】 ;
2、国家药品审评机构处理【9】:
(1)技术审评不通过,不予以批准;
(2)技术审评通过+超过等待期:国务院药品监督管理部门未收到人民法院的生效判决或者调解书,或者国务院专利行政部门的行政裁决,按照程序将相关仿制药注册申请转入行政审批环节(正常进行处理);
(3)技术审评通过+未超等待期;
(a)确认落入保护范围:技术审评通过后,专利权期限届满后转入行政审批;
(b)无争议(未落入保护范围或双方和解)、转入行政审批;
(c)相关专利被依法无效的,转入行政审批;
(4)行政审批期间,确认落入保护范围,交回技术评审。
3、对于暂缓批准【9】:
国务院药品监督管理部门作出暂缓批准决定后,推翻原结果的,仿制药申请人可以向国务院药品监督管理部门申请批准仿制药上市,国务院药品监督管理部门可以作出是否批准的决定。
九、无异议的后果:
1、前提:无异议(专利权人或者利害关系人未在规定期限内提起诉讼或者请求行政裁决)【8】;
2、对化学仿制药处理【10】:
(1)国务院药品监督管理部门根据技术审评结论和仿制药申请人提交的声明情形,直接作出是否批准上市的决定;
(a)对一类、二类声明,国务院药品监督管理部门依据技术审评结论作出是否批准上市的决定;
(b)对三类声明的化学仿制药注册申请,技术审评通过的,作出批准上市决定,相关药品在相应专利权有效期和市场独占期届满之后方可上市;
(c)对四类声明的化学仿制药注册申请,“未明确规定”;
3、对于中药同名同方药和生物类似药注册申请【13】:
国务院药品监督管理部门依据技术审评结论,直接作出是否批准上市的决定(不需要考虑声明类型)。
十、确认不侵权:
1、针对对象:化学仿制药申请人【8】;
2、具体依据:仿制药申请人可以按相关规定提起诉讼或者请求行政裁决,以确认其相关药品技术方案不落入相关专利权保护范围(主要是针对第四类:应该被宣告无效或不侵权)【8】;
3、时限要求:专利权人或者利害关系人在国家药品审评机构公开药品上市许可申请之日起45日内不提起诉讼的,药品上市许可申请人可以提起诉讼或提起行政裁决请求,被告或被申请人为专利权人。
十一、对挑战专利者的鼓励:
1、针对对象:对首个挑战专利成功并首个获批上市的化学仿制药(挑战专利成功是指化学仿制药申请人提交四类声明,且根据其提出的宣告专利权无效请求,相关专利权被宣告无效,因而使仿制药可获批上市)【11】;
2、挑战专利成功后果【11】:
(1)对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期:市场独占期内不再批准同品种仿制药上市(技术审评正常进行,市场独占期后转入行政审批),但共同挑战成功的可以批准;
(2)市场独占期一般为12个月,但不超过被挑战药品的原专利权期限。
十二、针对中药同名同方药、生物类似药特殊规定
1、对于人民法院或者国务院专利行政部门确认相关技术方案落入相关专利权保护范围的,相关药品在相应专利权有效期届满之后方可上市【13】;
2、无等待期;
3、无挑战成功的市场独占期。
十三、被批准上市后处理:
1、化学仿制药、中药同名同方药、生物类似药等被批准上市后,专利权人或者利害关系人认为相关药品侵犯其相应专利权,引起纠纷的,依据《中华人民共和国专利法》等法律法规相关规定解决【14】;
2、已经依法批准的药品上市许可决定不予撤销,不影响其效力【14】。
十四、失信行为:
提交不实声明等弄虚作假的、故意将保护范围与已获批上市药品无关或者不属于应当登记的专利类型的专利登记至中国上市药品专利信息登记平台、侵犯专利权人相关专利权或者其他给当事人造成损失的,依法承担相应责任【15】。
抛砖引玉,希望大家多提宝贵意见。
作者简介:李兆岭



